邓梦,金春明,高宇,张航,丁鑫哲
1牡丹江医学院第一临床医学院,黑龙江 牡丹江 157000
2牡丹江医学院附属红旗医院检验科,黑龙江 牡丹江 157000
乳腺癌是一种起源于乳腺组织的恶性肿瘤,2020年全球癌症统计数据显示,由于主要危险因素的不断变化,如推迟生育、生育次数减少、超重、肥胖和缺乏运动,乳腺癌的发病率已居全部恶性肿瘤第一位[1]。目前,越来越多的证据揭示了乳腺癌发生发展过程中的多种调控机制,此过程涉及关键的驱动因子和抑制因子,这两类因子均参与了肿瘤进展过程,表观遗传改变在致癌基因和抑癌基因的失调中也起到了重要作用,非编码RNA作为表观调控因子参与了乳腺癌进展的调控[2]。目前乳腺癌的确切发病机制仍不清楚。因此,研究乳腺癌进展过程中的潜在分子机制可为诊断和治疗乳腺癌奠定基础。微小RNA(microRNA,miRNA)参与并调控细胞多种生物学过程[3],miRNA与癌变有关,可作为非侵入性肿瘤诊断和预后标志物[4]。miRNA-4295 位于染色体10q25.2,是一个独特的miRNA。目前的证据表明,miRNA-4295 通过调控不同的靶基因在不同肿瘤的进展过程中发挥重要作用,如前列腺癌[5]、胃癌[6]、膀胱癌[7]等。过表达的miRNA-4295 可通过直接靶向肿瘤蛋白63(tumor protein 63,TP63)、RUNX 家族转录因子3(RUNX family transcription factor 3,RUNX3)、磷脂酰肌醇蛋白聚糖5(glypican 5,GPC5)、细胞周期蛋白依赖性激酶抑制剂1A(cyclin dependent kinase inhibitor 1A,CDKN1A)、B 细胞易位基因1(B-cell translocation gene 1,BTG1)、神经细胞正五聚体1(neuronal pentraxin 1,NPTX1)、富亮氨酸重复序列免疫球蛋白样结构域1(leucine rich repeats and immunoglobulin like domains 1,LRIG1)和非受体蛋白质酪氨酸磷酸酶14(protein tyrosine phosphatase non-receptor type 14,PTPN14)促进肿瘤进展,发挥致癌功能。此外,miRNA-4295 也可以通过N-myc/miRNA-4295/RUNX3、miRNA-4295/GPC5/WNT/β-联蛋白(β-catenin)和miRNA-4295/表皮生长因子受体(epidermal growth factor receptor,EGFR)/磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)信号通路发挥作用。然而,miRNA-4295在乳腺癌中的具体作用机制尚未阐明。研究发现,egl-9 家族缺氧诱导因子3(egl-9 family hypoxia inducible factor 3,EGLN3)在乳腺癌中表达上调[8],而miRNA-4295 对EGLN3 表达的影响尚不清楚。本研究探讨miRNA-4295 在乳腺癌中的表达及作用机制,现报道如下。
1.1 一般资料
选取2020—2022年牡丹江医学院附属红旗医院收治的乳腺癌患者。纳入标准:50~75 岁;
女性;
临床资料完整;
经病理检查首次确诊为乳腺癌;
未接受过抗肿瘤治疗。排除标准:非原发性乳腺癌。依据纳入和排除标准,本研究共纳入36 例患者。收集所有患者的乳腺癌组织和癌旁组织。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 细胞、主要试剂和仪器
乳腺癌细胞系MDA-MB-231、MCF-7、SKBR-3和人正常乳腺上皮细胞系MCF-10A 均购自中科院上海细胞库。Lipofectamine 3000 和BCA 蛋白检测试剂盒均购自美国Invitrogen 公司,RNAiso Plus 试剂盒、PrimeScriptTMRT Reagent Kit 和TB Green®Premix Ex TaqTMⅡ均购自宝日医生物技术(北京)有限公司,转染序列和引物均购自通用生物(安徽)股份有限公司,EGLN3 和β-微管蛋白(β-tubulin)一抗均购自武汉三鹰生物技术有限公司,膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自大连美仑生物科技有限公司,Cell Counting Kit-8 试剂盒购自同仁化学研究所。高速低温组织研磨仪购自武汉赛维尔生物科技有限公司,超微量分光光度计购自深圳市恩科生物科技有限公司,基因扩增仪和荧光定量聚合酶链反应检测系统均购自杭州博日科技股份有限公司,流式细胞仪购自艾森生物(杭州)有限公司,自动酶标仪购自博科控股集团有限公司。
1.3 实验方法
1.3.1 细胞培养及转染将MCF-10A 细胞置于专用培养基,MCF-7 和MDA-MB-231 细胞置于含10%胎牛血清(fetal bovine serum,FBS)的MEM 培养基,SKBR-3 细胞置于含10%FBS 的DMEM 培养基中培养。选取MCF-7 细胞,对照组不做任何处理;
miRNA-NC 组转染50 nmol/L 的空白序列5"-UUUGUACUACACAAAAGUACUG-3",以排除转染操作导致的影响;
miRNA-4295 组转染50 nmol/L的miRNA-4295 过表达序列5"-CAGUGCAAUGUUUUCCUUTT-3",以提高细胞中miRNA-4295 的表达水平。
1.3.2 定量逆转录聚合酶链反应(quantitative reverse transcription- polymerase chain reaction,qRT-PCR)检测miRNA-4295 相对表达量采用RNAiso Plus 试剂盒提取总RNA,采用Prime-ScriptTMRT reagent Kit 合成互补DNA(complementary DNA,cDNA),采用TB Green®Premix Ex TaqTMⅡ进行qRT-PCR,检测EGLN3、miRNA-4295 相对表达量。EGLN3、GAPDH、miRNA-4295 和U6引物序列见表1。qRT-PCR 扩增条件:95 ℃30 s 预变性;
95 ℃5 s 变性,60 ℃30 s 退火,95 ℃15 s 延伸,共40 个循环;
熔解曲线60 ℃30 s,90 ℃15 s。

表1 qRT-PCR 引物序列
1.3.3 蛋白质印迹(Western blot)法检测EGLN3蛋白表达将miRNA-4295 和miRNA-NC 转染至MCF-7 细胞中。72 h 后消化细胞并转移至1.5 ml EP 管中,4 ℃1000 r/min 离心5 min 后收集细胞,采用1×Loading Buffer 裂解,煮沸5 min。采用BCA蛋白浓度测定试剂盒检测蛋白浓度。取蛋白样品,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE),200 V 恒压55 min 分离蛋白质,18 V 恒压转聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜50 min。将PVDF 膜置于封闭液中,室温摇动封闭至少30 min。加入兔抗EGLN3(1∶1000)和鼠抗β-tubulin(1∶1000)多克隆抗体,4 ℃摇床孵育过夜;
取出PVDF 膜,摇床上采用1×TBST 洗涤;
辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔和羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)抗体与二抗稀释液(5%脱脂奶粉)按1∶4000 的体积比混合制备二抗,将二抗置于摇床上孵育1 h;
取出PVDF 膜,摇床上采用1×TBST洗涤。采用电化学发光(electrochemiluminescence,ECL)液显影2 min,立即将PVDF 膜置于曝光盒中,并在暗室中对感光胶片进行曝光,然后进行显影、定影处理。
1.3.4 CCK8 法检测细胞增殖情况将miRNA-4295 转染至MCF-7 细胞中。转染72 h 后消化并计数细胞,接种于96 孔板(1×104/孔)中,总反应体积为每孔100 μl。每组设置3 个复孔、4 个时间点(24、48、72、96 h)。在相应的时间点每孔加入10 μl CCK8 检测液,孵育2 h,450 nm 处测定光密度(optical density,OD)值。
1.3.5 划痕实验检测细胞迁移情况将MCF-7 细胞接种于6 孔板(5×105/孔)中,转染miRNA-4295 和miRNA-NC。待转染细胞长满培养皿底部后,使用10 μl 微量加样吸头划痕。在0、24 h 时使用光学显微镜拍照,Image J 软件分析细胞的迁移距离,计算细胞迁移率。24 h迁移率=(0 h的划痕面积-24 h的划痕面积)/0 h 的划痕面积。
1.3.6 流式细胞仪检测细胞周期MCF-7 细胞转染72 h 后收集细胞,获得单个细胞,加入3 ml 预冷的无水乙醇,4 ℃固定24 h。按照染色缓冲液∶PI染色液(20×)∶RNase A(50×)=100∶5∶2 的比例混合配置成染色工作液。每管样品加入500 μl 配制好的染色工作液,37 ℃避光染色30 min。染色完成后,在24 h 内采用流式细胞仪和NovoExpress 软件分析细胞周期。
1.3.7 流式细胞仪检测细胞凋亡情况将MCF-7细胞接种于24 孔板中,待细胞贴壁后转染细胞。72 h 后收集细胞,预冷磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞。应用Annexin VFITC/PI 凋亡检测试剂盒进行染色,流式细胞仪检测细胞凋亡情况。
1.4 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验;
不符合正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,组间比较采用Wilcoxon 秩和检验。采用Spearman 相关分析法分析miRNA-4295 与EGLN3 表达的相关性。以P﹤0.05 为差异有统计学意义。
2.1 miRNA-4295 在乳腺癌组织和细胞系中表达情况的比较
乳腺癌组织中miRNA-4295 相对表达量为0.05(0.03,1.06),明显低于癌旁组织的1.23(1.10,1.60),差异有统计学意义(Z=2.940,P=0.003)。乳腺癌细胞系MDA-MB-231、MCF-7 和SKBR-3 中miRNA-4295 相对表达量均低于人正常乳腺上皮细胞系MCF-10A,差异均有统计学意义(P﹤0.01)(表2)。miRNA-4295 在乳腺癌细胞系MCF-7 中相对表达量最低,因此选定MCF-7 细胞系用于后续实验。
表2 不同细胞系中miRNA-4295 相对表达量的比较(±s)

表2 不同细胞系中miRNA-4295 相对表达量的比较(±s)
注:*与MCF-10A细胞系比较,P<0.01
细胞系MCF-10A MDA-MB-231 MCF-7 SKBR-3 F值P值miRNA-4295相对表达量1.75±0.26 0.56±0.20*0.31±0.10*0.58±0.12*49.591 0.000
2.2 miRNA-4295 相对表达量及OD 值的比较
miRNA-4295 组MCF-7 细胞中miRNA-4295 相对表达量高于对照组和miRNA-NC 组,差异均有统计学意义(P﹤0.05)(表3)。转染24、48、72、96 h,miRNA-4295 组MCF-7 细胞OD 值均明显低于对照组,差异均有统计学意义(P﹤0.01)(表4)。
表3 不同组别MCF-7 细胞中miRNA-4295 相对表达量的比较(±s)

表3 不同组别MCF-7 细胞中miRNA-4295 相对表达量的比较(±s)
注:a与对照组比较,P<0.05;
b与miRNA-NC组比较,P<0.05
组别对照组miRNA-NC组miRNA-4295组F值P值miRNA-4295相对表达量0.95±0.09 0.95±0.35 36.12±6.11a b 40.196 0.008
表4 不同时间不同组别MCF-7 细胞OD 值的比较(±s)

表4 不同时间不同组别MCF-7 细胞OD 值的比较(±s)
组别对照组miRNA-4295组t值24 h 0.58±0.02 0.51±0.02 6.337 48 h 1.10±0.05 0.96±0.05 5.354 72 h 1.72±0.13 1.41±0.10 5.099 96 h 1.83±0.07 1.49±0.10 7.514 P值0.000 0.000 0.000 0.000
2.3 细胞迁移能力的比较
miRNA-4295 组MCF-7 细胞的迁移率明显低于对照组和miRNA-NC 组,差异均有统计学意义(P﹤0.05)。(表5)
表5 不同组别MCF-7 细胞迁移率的比较(%,±s)

表5 不同组别MCF-7 细胞迁移率的比较(%,±s)
注:a与对照组比较,P<0.05;
b与miRNA-NC组比较,P<0.05
组别对照组miRNA-NC组miRNA-4295组F值P值迁移率43.40±2.74 42.76±2.00 33.92±2.94a b 14.456 0.003
2.4 细胞周期的比较
对照组MCF-7 细胞中,G1期17%,G2期11%,S期5%;
miRNA-NC 组MCF-7 细胞中,G1期17%,G2期10%,S 期6%;
miRNA-4295 组MCF-7 细胞中,G1期18%,G2期6%,S期10%。miRNA-4295组MCF-7细胞中S 期细胞比例增加,G2期细胞比例降低。
2.5 细胞凋亡情况的比较
miRNA-4295组与对照组、miRNA-NC组MCF-7细胞凋亡率比较,差异均无统计学意义(P﹥0.05)。(表6)
表6 不同组别MCF-7 细胞的凋亡率(%,±s)

表6 不同组别MCF-7 细胞的凋亡率(%,±s)
组别对照组miRNA-NC组miRNA-4295组细胞凋亡率1.19±0.38 1.29±0.09 1.10±0.11
2.6 EGLN3 mRNA 和蛋白表达水平的比较
乳腺癌组织中EGLN3mRNA 相对表达量为1.48(1.11,1.95),明显高于癌旁组织的0.89(0.60,1.02),差异有统计学意义(Z=3.26,P=0.001),且乳腺癌组织中EGLN3 蛋白表达水平高于癌旁组织(图1)。同时,miRNA-4295 与EGLN3 表达呈负相关(r=-0.656,P=0.002)。miRNA-4295 组MCF-7 细胞中EGLN3mRNA 相对表达量低于对照组和miRNA-NC 组,差异均有统计学意义(P﹤0.05)(表7、图2)。

图1 Western blot法检测乳腺癌组织和癌旁组织中EGLN3蛋白表达情况

图2 Western blot法检测不同组别MCF-7细胞中EGLN3蛋白表达情况
表7 不同组别MCF-7细胞中EGLN3 mRNA相对表达量的比较(±s)
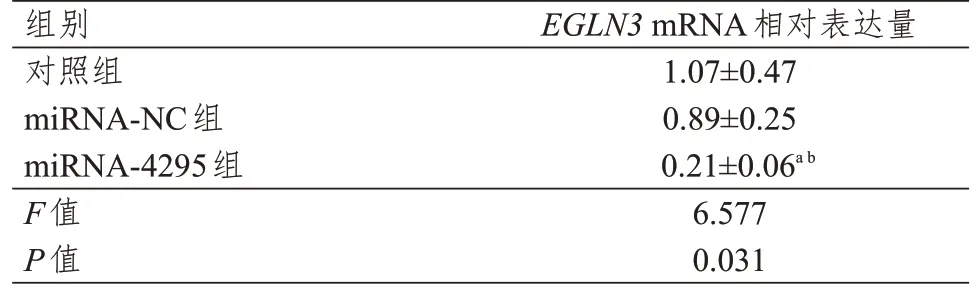
表7 不同组别MCF-7细胞中EGLN3 mRNA相对表达量的比较(±s)
注:a与对照组比较,P<0.05;
b与miRNA-NC组比较,P<0.05
组别对照组miRNA-NC组miRNA-4295组F值P值EGLN3 mRNA相对表达量1.07±0.47 0.89±0.25 0.21±0.06a b 6.577 0.031
近年来的研究显示,乳腺癌的发生发展过程中存在多种基因异常表达[9]。miRNA 在肿瘤的发生发展过程中可作为致癌基因或抑癌基因通过不同的信号通路调控细胞增殖、迁移和侵袭,从而形成一个复杂的生物分子调控网络[10-14]。目前的证据表明,miRNA-4295 与肿瘤进展密切相关。miRNA-4295在非小细胞肺癌中表达下调,过表达miRNA-4295可通过靶向泛素特异肽酶28(ubiquitin specific peptidase 28,USP28)抑制非小细胞肺癌的进展[15]。miRNA-4295 在药物作用方面也体现出了研究价值,枸杞多糖、人参皂苷、顺铂和其他药物均能够影响miRNA-4295 的表达和下游基因的生物学效应。miRNA-4295 表达下调能够提高胃癌患者对化疗药物顺铂的敏感性;
水溶性紫杉醇前体药物可通过提高Dicer 蛋白表达水平促进miRNA-4295的成熟,从而促进膀胱癌进展[7];
枸杞多糖能够上调miRNA-4295 的表达,从而防止因高浓度H2O2导致的氧化损伤[16]。上述结果都表明,miRNA-4295可能是一个新的疾病治疗靶点。本研究结果显示,乳腺癌组织中miRNA-4295相对表达量明显低于癌旁组织(P﹤0.01),乳腺癌细胞系MDA-MB-231、MCF-7 和SKBR-3 中miRNA-4295 相对表达量均低于人正常乳腺上皮细胞系MCF-10A(P﹤0.01)。过表达miRNA-4295 后,MCF-7 细胞增殖能力降低,迁移率下降,细胞凋亡率未见明显变化,说明miRNA-4295 可抑制乳腺癌细胞增殖和迁移。转染miRNA-4295 后,MCF-7 细胞中S 期细胞比例增加,G2期细胞比例降低,表明miRNA-4295 可阻滞细胞周期。以上结果提示,miRNA-4295 在乳腺癌中作为抑癌基因存在,但过表达miRNA-4295 并不会增加细胞凋亡率。
EGLN3位于染色体14q13.1,缺氧会诱导EGLN3表达[17-18]。EGLN3 单克隆抗体可作为肾细胞癌的血清学标志物[19]。同时,EGLN3 可影响某些信号通路[20-21],在多种肿瘤中作为肿瘤因子,在细胞增殖、凋亡、迁移、侵袭和血管生成过程中发挥作用,被认为是一个有吸引力的治疗靶点[20-26]。有研究通过对癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库与基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库中乳腺癌患者数据进行分析,证明EGLN3 在乳腺癌中高表达[8],敲低细胞中EGLN3表达后,细胞增殖、克隆形成、侵袭和迁移能力均降低,但其作用机制仍需进一步的研究证明。本研究结果显示,乳腺癌组织中EGLN3mRNA 相对表达量高于癌旁组织,与上述结果一致。相关性分析结果显示,miRNA-4295 与EGLN3 表达呈负相关,过表达miRNA-4295 后,EGLN3mRNA 和蛋白表达水平均降低,表明miRNA-4295 可以调控EGLN3 的表达,EGLN3可能是miRNA-4295 的靶基因之一,但具体调控机制仍需进一步研究。
综上所述,miRNA-4295可抑制乳腺癌细胞增殖和迁移,并阻滞细胞周期。miRNA-4295 和EGLN3可能是乳腺癌诊断和治疗的潜在靶点,miRNA-4295特定的调控机制有待进一步研究。随着对miRNA研究的不断深入,可能会探索miRNA-4295 越来越多的功能和相关靶点。
猜你喜欢迁移率细胞系试剂盒SiC/SiO2界面形貌对SiC MOS器件沟道迁移率的影响浙江大学学报(工学版)(2016年2期)2016-06-05STAT3对人肝内胆管癌细胞系增殖与凋亡的影响山东医药(2015年14期)2016-01-12GlobalFiler~? PCR扩增试剂盒验证及其STR遗传多态性法医学杂志(2015年4期)2016-01-06GoldeneyeTM DNA身份鉴定系统25A试剂盒的法医学验证法医学杂志(2015年4期)2016-01-06滤棒吸阻和滤嘴长度对卷烟烟气中6种元素迁移率的影响烟草科技(2015年8期)2015-12-20抑制miR-31表达对胰腺癌Panc-1细胞系迁移和侵袭的影响及可能机制江苏大学学报(医学版)(2015年2期)2015-04-17E3泛素连接酶对卵巢癌细胞系SKOV3/DDP顺铂耐药性的影响中国医药导报(2015年26期)2015-02-28高迁移率族蛋白B1对16HBE细胞血管内皮生长因子表达和分泌的影响郑州大学学报(医学版)(2015年1期)2015-02-27基于六普数据的年龄—迁移率模型研究中央民族大学学报(自然科学版)(2014年4期)2014-06-09牛结核病PCR诊断试剂盒质量标准的研究当代畜禽养殖业(2014年6期)2014-02-27