金玉琴 张 远 吕浩东 李贵凤 季 骏
目前关于力学刺激对牙周膜成纤维细胞(periodontal ligament fibroblasts,PDLFs)的生物学反应的研究多数局限于体外研究[1,2],而关于体内正畸牙移动过程中PDLFs对正畸力的生物学反应及相关的力学信号转导机制的研究报道较少,有待深入探索。近年来,随着细胞生物力学的发展,学者们开始关注机械力刺激对PDLFs生物学行为的影响,包括细胞增殖和分化,细胞因子的表达等,并取得了较多进展[3]。其中,血小板衍生生长因子-BB(platelet derived growth factor-BB,PDGF-BB)是多功能生长因子,它对成纤维细胞、周细胞、干细胞等具有促增殖和趋化性,在体内创伤愈合和组织修复过程中发挥至关重要的作用[4,5]。PDGF-BB也可以刺激骨祖细胞或间充质干细胞(mesenchymal stem cells,MSCs)等成骨分化,从而促进骨再生。目前已经知道PDGF-BB主要通过结合其受体PDGFRα或β来激活下游信号通路,从而发挥促细胞增殖、成骨分化等重要的生物学功能[6]。PDGF-BB/PDGFRs是成纤维细胞、周细胞和平滑肌细胞的重要调节因子。而PDGFRβ在成纤维细胞中广泛表达,但是在正畸牙移动过程中,在正畸应力刺激下牙周膜中成纤维细胞是否对PDGF-BB有反应以及PDGFRβ表达是否上调,有待深入研究。
为此,本课题首先构建大鼠上颌正畸牙移动模型,检测在正畸应力刺激下张应力侧新骨形成情况,并研究在牙周膜中PDGF-BB、PDGFRβ表达水平是否发生变化,以期为促进骨改建、加速临床正畸治疗提供新的思路。
1.主要材料
镍钛螺旋拉簧(3M Unitek Monrovia,美国),正畸结扎丝(杭州奥杰医疗器械有限公司,中国),盐酸四环素、茜素红(Sigma,美国),BSA(Servicebio,中国)、α-SMA抗体、PDGF-BB、PDGFR-β(Abacam,美国)、DAB显色试剂盒(DAKO,丹麦)。
2.动物实验分组
本部分实验共32只雄性SD大鼠,所有大鼠左侧构建正畸牙移动模型,右侧不加力,设为对照。其中,随机选取16只大鼠于术后7天、14天进行序列荧光标记,术后28天时处死取材观察新骨沉积情况,实验分组为2组,分别为张应力组(Tension)、压应力组(Pressure);
另外16只大鼠,分别于术后7天(n=8)、14天(n=8)处死取材进行免疫组化染色或者免疫荧光双染,实验分组为:不加力组(control组)、加力7天组(day7)、加力14天组(day14)。所有动物实验程序均经南京大学实验动物福利伦理审查委员会批准,伦理批准文号为2019NL-009(KS)。所有涉及大鼠的实验都是按照相关指南和规定进行[7]。
3.大鼠正畸牙移动实验
首先建立标准的大鼠正畸牙移动模型[8]。手术在SPF级动物房中操作,首先75%酒精消毒腹部,腹腔注射2%戊巴比妥钠麻醉大鼠。待麻醉后,将大鼠仰卧位固定,在大鼠上颌两个中切牙的近、远中颈缘处磨出深约0.15~0.25 mm的槽沟以防结扎丝的滑脱,增加其固位。然后左侧用0.20 mm正畸不锈钢结扎丝穿过第一、二磨牙邻接点下方,将结扎丝包绕第一磨牙牙颈部结扎固定,并于镍钛拉簧的一端连接固定,使拉簧固定于左侧上颌第一磨牙与上颌切牙之间,力值为50 g左右。上颌右侧第一磨牙不加力,设为对照侧(图1)。

图1 大鼠正畸牙移动模型的建立
4.序列荧光标记实验
随机选取16只大鼠,于正畸牙移动术后7天、14天,分别按照25 mg/kg、30 mg/kg的剂量腹腔注射盐酸四环素(Tetracycline,TE)、茜素红(Alizarin,AL)等钙离子螯合剂以对牙周张应力侧新骨进行标记,检测新骨形成和矿化的速率[9]。
5.组织学检测
术后28天,处死上述16只大鼠,获取大鼠上颌骨,固定于10%福尔马林。标本梯度脱水,纯二甲苯透明,包埋至固化,用Lecia-SP硬组织切片机将硬化的标本沿横断面(n=8)或矢状面(n=8)连续切片,切片厚度约为150μm,手工磨片、抛光至30~40 μm。将上述沿横断面切的切片置于激光共聚焦显微镜下进行观察序列标记的绿色、红色荧光标记情况。两种荧光的激发/发射波长分别为405/580 nm(TE,绿)、543/617 nm(AL,红色)。并采用图像分析软件Image Pro Plus根据切片上荧光条带之间的距离计算骨矿化沉积速度(mineral apposition rate,MAR,um/day)[9]。
6.免疫组织化学染色
剩余的16只大鼠分别于术后7天(n=8)、14天(n=8)处死,获取上颌骨,福尔马林固定24小时,然后放入10%EDTA中4℃下进行脱钙6周左右,直至针尖可以轻易穿透牙齿。标本梯度乙醇脱水,常规石蜡包埋,用切片机沿磨牙长轴方向(矢状向)进行切片,制备4μm的连续石蜡切片,然后将切片置于60℃烤箱中烤片2小时,后续实验备用。
将石蜡切片常规脱蜡,梯度乙醇下行水化,抗原修复,用3%双氧水阻断内源性过氧化物酶,血清封闭,油性笔圈定区域后分别滴加抗α-SMA(1:200)、PDGF-BB(1:100)及PDGFR-β(1:100)一抗,置于湿盒中4℃孵育过夜。次日复温后PBS冲洗3次,加二抗37℃孵育30分钟,PBS冲洗3次,DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明胶,中性树胶封片,3D数字切片扫描仪扫描片子,用Case Viewer 2.3软件打开片子进行观察并拍照记录。最后的免疫组化评分是用强度评分和百分比评分相乘来计算[10]。
7.组织免疫荧光双染
石蜡切片脱蜡,梯度乙醇下行水化,抗原修复,3%BSA封闭,油性笔圈定区域后同一张切片上滴加抗α-SMA(1:300)、PDGFR-β(1:200)的一抗混合液,湿盒中4℃孵育过夜,次日复温,PBS冲洗3次,每次3分钟,甩干后滴加FITC标记山羊抗兔IgG和TRITC标记山羊抗鼠IgG混合荧光二抗(1:500),37℃孵育,PBS冲洗3次,滴加DAPI溶液(1μL DAPI+1mL PBS)染细胞核,滴加防荧光淬灭封片剂封片,晾干,激光共聚焦显微镜下观察,绿色荧光(激发光405 nm)、红色荧光(激发光543 nm)为阳性表达,核呈蓝色荧光(激发光359 nm)。每张切片随机选取3个不重叠的高倍视野进行观察、拍照。
8.统计学分析
数据用均数±标准差方式表示,应用SPSS18.0统计软件处理。采用完全随机设计的单因素方差分析和Student-Newman-Keuls(SNK)进行统计分析。P<0.05视为差异有统计学意义。
1.大鼠正畸牙移动模型建立
实验发现上颌左侧第一磨牙在螺旋拉簧的机械作用力下均发生了向近中的移动,左侧第一磨牙和第二磨牙之间出现肉眼可见的间隙,而右侧对照侧无明显间隙,表明大鼠正畸牙移动模型建立成功(图2)。
图2 第7天正畸牙近中移动的典型图像
2.序列荧光标记检测结果
分别于正畸牙移动第7天、14天对第一磨牙牙槽骨新骨矿化沉积活动进行四环素(绿色)、茜素红(红色)荧光标记,然后于第28天取材后在激光共聚焦显微镜下观察。实验检测结果如图3A所示,张应力侧可见绿色荧光条带沉积,红色荧光沉积更明显、面积更大,而压应力侧无明显绿色荧光显现,只有少量红色荧光。张力侧荧光面积明显大于压力侧,说明压力侧无明显骨化沉积活动,相反,张应力侧有大量新骨增生、沉积。而红色、绿色荧光带之间的宽度表示新骨的宽度,通过两种颜色标记条带之间的距离计算新骨矿化沉积速率(mineral apposition rate,MAR),结果分析发现张应力侧骨矿化沉积显著快于压应力侧(图3B),具有统计学差异(P<0.01)。
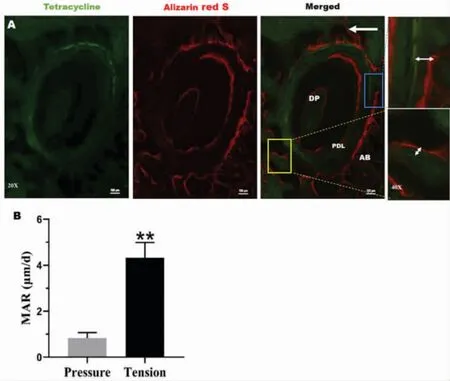
图3 正畸牙移动28天后,序列荧光标记观察加力侧新生骨组织(A)及定量分析新骨矿化速率(B)
3.张应力侧牙周膜免疫组化染色结果
在正畸牙移动模型中,通过免疫组化检测在张应力刺激下张应力侧PDLFs的α-SMA、PDGF-BB、PDGFRβ表达是否上调。结果图4所示,对照组PDLFs表达α-SMA,呈浅褐色,而在加力7天后张应力区广泛表达α-SMA,且颜色加深,呈棕褐色。表明张应力刺激下PDLFsα-SMA高表达,在7天时达到峰值,与对照组相比具有显著差异(P<0.01)。随后在第14天时,α-SMA的表达有所下降,但仍然强于对照组(P<0.01)。对照组牙周膜中只有少量PDGF-BB表达,而在张应力刺激下第7天PDGFBB表达升高,在第14天PDGF-BB表达稍下降,呈浅褐色,相比对照组均具有统计学意义(P<0.01)。PDGFRβ在对照组牙周膜中只有零星细胞呈弱阳性表达,随后在张应力刺激下,PDGFRβ表达逐渐增强,7天时染色最深,呈棕色,之后逐渐减弱,14天时仍有阳性表达。加力组PDGFRβ阳性细胞数均大于对照组,具有统计学差异(P<0.01)。

图4 大鼠正畸牙移动过程中,第一磨牙远中根远中区(张应力侧)α-SMA、PDGF-BB、PDGFR-β免疫组化染色(A)及半定量分析(B)
4.牙周膜α-SMA和PDGFRβ蛋白共定位情况
通过石蜡切片上免疫荧光双重染色PDGFRβ、α-SMA,确认PDGFRβ是否在α-SMA+PDLFs上表达,以及确认张应力刺激下α-SMA+PDLFs上PDGFRβ表达是否上调。如图5所示,正常对照组双侧可观察到染色较浅的红色荧光(α-SMA),且绿色荧光(PDGFRβ)也显示相同的表达情况,从Merged图可以观察到少量绿色荧光与红色荧光共存于同一细胞。而在正畸加力7天后,张应力侧牙周膜α-SMA、PDGFRβ相比对侧压应力侧染色明显增强,从Merged图上可以看出张应力侧α-SMA和PDGFRβ表达共定位的细胞数目显著增加,呈黄色,说明张应力刺激下上调了α-SMA+PDLFs上的PDGFRβ表达。

图5 正畸牙移动7天后,上颌骨左侧牙周膜张应力区和压应力区免疫荧光标记α-SMA(红色)、PDGFR-β(绿色)、DAPI(蓝色)的典型图像
牙周膜和牙槽骨的改建是正畸牙齿移动的基础[11,12]。在正畸力作用下,牙周膜内细胞、组织对压缩和牵张应变的反应不同,最终导致压力侧牙槽骨发生骨吸收,张应力侧发生骨形成。压应力侧牙周间隙变窄,血流减少,胶原纤维和基质降解吸收,RANKL表达上调,导致破骨细胞分化,分泌细胞因子,溶解骨基质中的羟基磷灰石和有机质等骨组织成分,从而发生牙槽骨吸收;
张应力侧牙周间隙变宽,血流量增多,胶原纤维和基质增生,成骨因子Runx-2、OPG等表达升高,骨基质分泌、矿化,继而新生骨沉积[13]。序贯荧光标记方法用于示踪骨组织新生或改建过程中的钙盐沉积活动,可记录不同阶段新骨形成速度,已被作为骨再生研究中的常规检测手段广泛应用[14]。而本实验中通过序列荧光标记发证实了在加力28天后张应力侧的确有大量新骨沉积,这有利于牙齿移动到新的位置并稳定下来。
牙周膜是牙周组织中可形变最大的组织,是正畸牙移动的关键[15,16]。PDLFs是牙周膜中的主体细胞,能够调节牙周膜代谢。且具有异质性,部分亚型具有成骨细胞的表型,可以在力学刺激下成骨向分化[17]。PDLFs能分泌多种细胞因子影响骨代谢,而且其自身功能和代谢也受很多细胞因子的调节和影响,间接调节骨形成和骨吸收活动[18]。同时PDLFs被认为是感受机械应变并做出机械反应第一受体[19,20]。在本实验中,免疫组化结果显示张应力侧α-SMA阳性的PDLFs明显增多,在加力第7天时达到峰值,推测是因为张应力刺激下PDLFs由相对静息状态转化为活化状态,从而细胞增殖活性增强,这与之前的一些研究结果相一致[21,22]。活化的成纤维细胞α-SMA表达会增多[23],本研究显示张应力刺激下张应力侧牙周膜中PDGF-BB、PDGFRβ表达均上调。有研究指出PDGFRβ的表达上调可作为成纤维细胞发挥功能的指标[24]。PDGF-BB主要由血管内皮细胞、巨核细胞和神经元细胞表达,主要以旁分泌的形式发挥作用[25,26]。体内研究表明,人重组PDGF-BB可以促进牙周组织再生,骨折和骨缺损的修复,加快组织愈合,提高成骨质量,促进牙周软硬组织的恢复,促进种植体周围骨组织形成[27]。而通过体内组织切片的免疫荧光共定位可以发现张应力刺激下PDGFRβ与α-SMA+的PDLFs共定位。由此推测在正畸力作用下,张应力侧PDLFs感受力学刺激,张应力刺激促进牙周膜中PDGF-BB表达,并且与α-SMA+/PDGFRβ+的PDLFs结合,发挥生物学作用。
综上所述,研究确定了大鼠正畸牙移动过程中张应力侧有大量新骨形成。本研究发现在正畸牙移动过程中牙周张应力侧PDGF-BB、PDGFRβ表达上调,而压应力侧无明显上调,推测这可能与PDGFBB/PDGFRβ参与正畸骨改建过程,但其详细的分子机制有待进一步的深入研究。
猜你喜欢牙周膜磨牙切片磨牙症各类垫的临床治疗研究现状与展望口腔医学(2021年10期)2021-12-02牙周膜干细胞BMP-2-PSH复合膜修复新西兰兔牙槽骨缺损昆明医科大学学报(2021年5期)2021-07-22维生素C对牙周膜干细胞中HDAC1和HDAC6表达的影响天津医科大学学报(2021年2期)2021-03-29新局势下5G网络切片技术的强化思考科学与财富(2020年15期)2020-07-04网络切片标准分析与发展现状移动通信(2019年4期)2019-06-25磨牙就是肚子里有蛔虫吗?儿童故事画报·发现号趣味百科(2016年7期)2017-02-08两种培养条件对牙周膜干细胞生物学特性影响的对比研究中华老年口腔医学杂志(2016年2期)2017-01-15CBCT对下颌磨牙根分叉病变的评价中华老年口腔医学杂志(2016年5期)2016-03-01肾穿刺组织冷冻切片技术的改进方法中国组织化学与细胞化学杂志(2016年3期)2016-02-27不同方法修复磨牙牙缺损的临床效果观察中国当代医药(2015年32期)2015-03-01